10.6.2025 | 07:53
Eftirlitsađilar bregđast trausti
Dánarlíkur Moderna tvíbólusettra 2021 á aldrinum 46 til 69 ára reyndust 50% hćrri en ţeirra sem fengu Pfizer. Ţví vekur furđu ţegar eftirlitsađilar veita nýju mRNA Covid bóluefni Moderna, mNEXSPIKE, markađsleyfi á grundvelli klínískrar rannsóknar ţar sem nýja efniđ var boriđ saman viđ eldra efniđ sem hafđi reynst svo hćttulegt ađ notkun ţess var hćtt víđa. Međal annars á Íslandi ţar sem hćtt var ađ nota efniđ í febrúar 2022 ţegar landsmenn höfđu ţegiđ 98.450 sprautur af Moderna. Íslenskir eldri borgarar verđa ađ vona ađ nýi landlćknirinn geri ríkari kröfur en eftirlitsađilinn til öryggis bóluefnisins og afţakki kaup á efninu.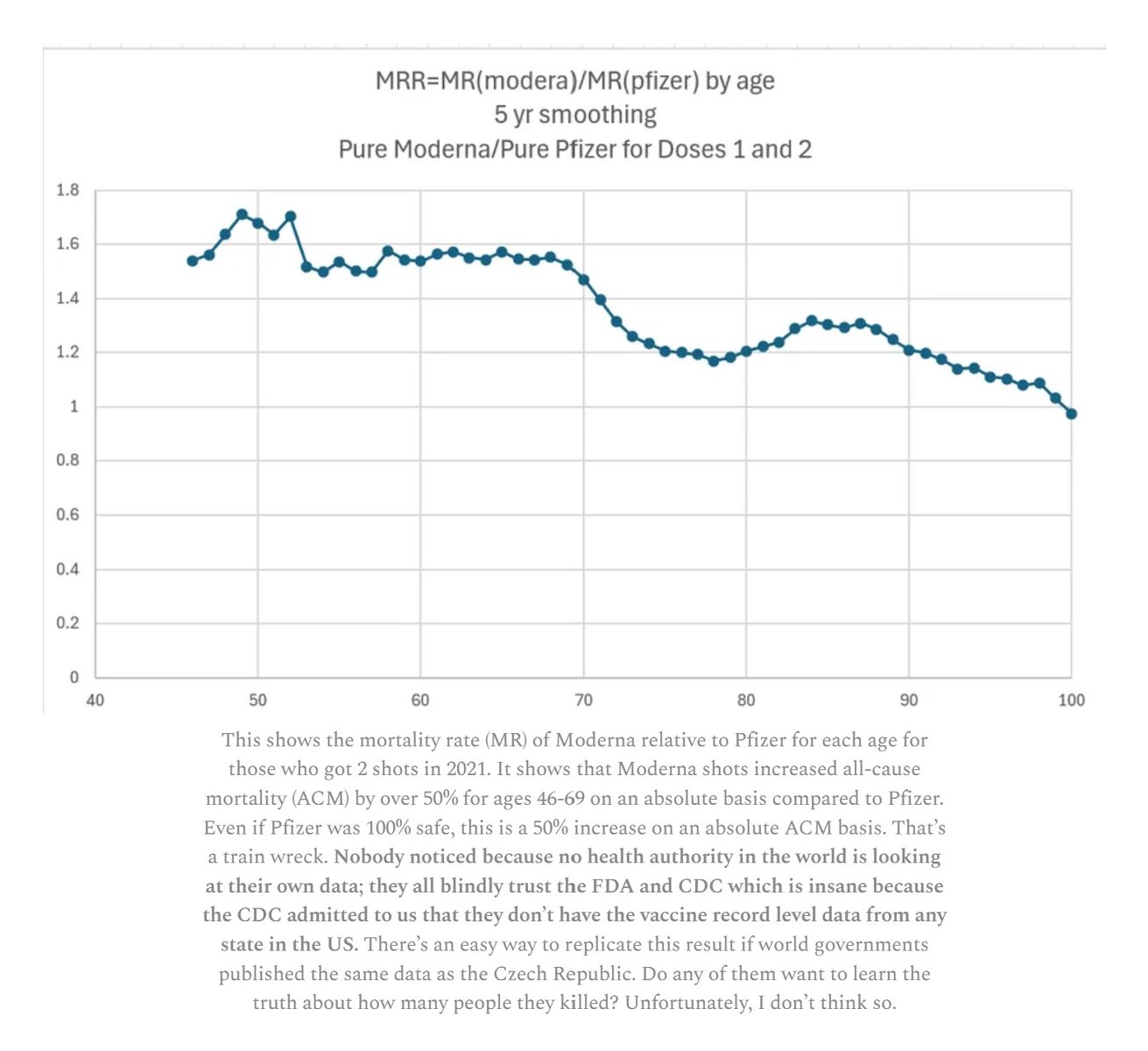
9.6.2025 | 09:49
Hlutfall landsmanna á endurhćfingarlífeyri tvöfaldast
Ađ međaltali fengu 2,8% landsmanna á aldrinum 18-66 ára greiddan endurhćfingarlífeyri á árinu 2024 samkvćmt ársskýrslu Tryggingastofnunar. Hlutfalliđ var 1,3% á árunum 2020 til og međ 2022. Tölur TR ásamt ţeirri stađreynd ađ óvíđa međal ţjóđa heims hafa hlutfallslega fleiri ţegiđ Covid mRNA bóluefniđ en hér á landi á sama tíma og Ísland skipast ár eftir ár í hóp ţeirra ţjóđa Evrópu sem hćst hafa hlutfall umframdauđsfalla eru enn ein vísbendingin um skađsemi bóluefnanna. Hliđstćđri reynslu greina Japanskir vísindamenn frá í grein í fagtímaritinu JMA Journal.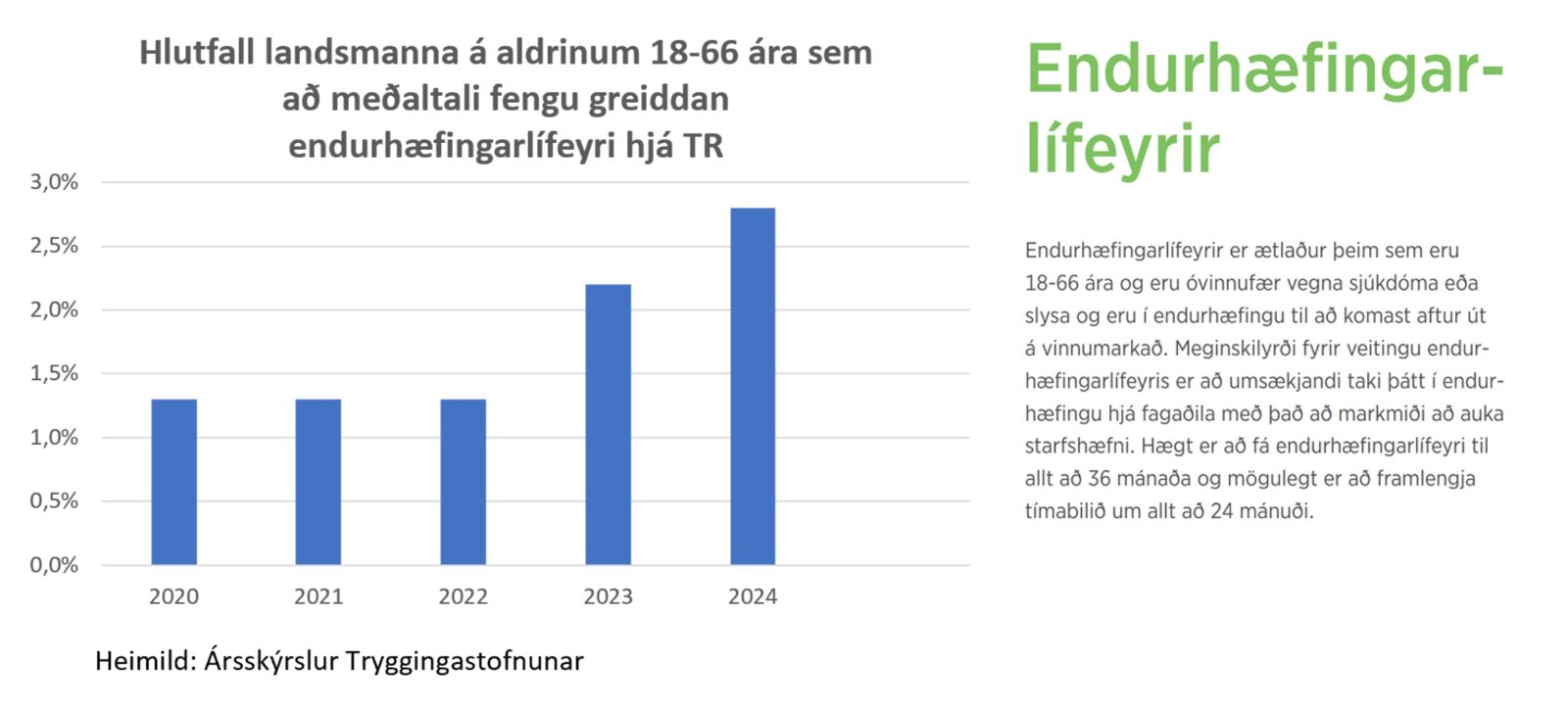
8.6.2025 | 17:32
Alvarlegar aukaverkanir 5,3% ungbarna í klínískri rannsókn MenQuadfi viđ meningókokkum
Fćstir heilbrigđisstarfsmenn og foreldrar gera sér grein fyrir ađ líklega hefur ekkert bóluefnanna sem notuđ eru í almennum barnabólusetningum á Íslandi undirgengist tvíblinda klíníska rannsókn ţar sem samanburđarhópnum var gefin lyfleysa (óvirkt efni eđa saltlausn). Hvernig FDA stóđ ađ samţykkt markađsleyfis fyrir bóluefniđ MenQuadfi sem gefiđ er viđ meningókokkum viđ eins árs aldur á Íslandi lýsir í hvert óefni er komiđ í starfsháttum FDA.
Leyfi FDA á ManQuadfi bóluefninu byggir á klínískri rannsókn ţar sem bóluefniđ var boriđ saman viđ bóluefniđ Menveo. Í rannsókninni fengu 5,3% ungbarnanna sem voru sprautuđ međ MenQuadfi alvarlegar aukaverkanir og 3,6% barnanna sem sprautuđ voru međ Menveo. Skilgreining FDA á alvarlegri aukaverkun er t.d. dauđi, spítalainnlögn og fćđingargalli. Ţrátt fyrir ađ hlutfall ungbarna sem fengu alvarlegar aukaverkanir af MenQuadfi vćri hátt og umtalsvert hćrra en ţeirra sem sprautuđ voru međ Menveo ákvađ FDA engu ađ síđur ađ úrskurđa bóluefniđ MenQuadfi „öruggt“ til notkunar í smábörnum vegna eldri ákvörđunar FDA um leyfi Menveo til handa. Leyfi Menveo byggđi á samanburđi viđ virkni bóluefnisins Menactra. Menactra hafđi fengiđ leyfi sem byggđi á klínískri rannsókn međ samanburđi viđ bóluefniđ Menomune frá 1978 en ţađ bóluefni hafđi ekki veriđ reynt í klínískri rannsókn eftir ţví sem hćgt er ađ finna í heimildum en kröfur um skjölun rannsókna var ekki jafn stíf ţá og nú til dags.
Notkun MenQuadfi treystir á samanburđ keđju klínískra rannsókna ţar sem virk efni en ekki lyfleysa var gefin samanburđarhópnum ađ síđasta bóluefninu undanskyldu sem ekki var reynt í klínískri rannsókn og leyfi bóluefnanna sem á eftir komu grundvallast á.
5.6.2025 | 09:19
VAERS međ 34 íslensk dauđsföll 2021 og 2022
4.6.2025 | 10:43
Landlćknir kveikti ekki á perunni
3.6.2025 | 14:06
Til ţess eru mistökin ađ lćra af ţeim
1.6.2025 | 17:43
