FŠrsluflokkur: Bloggar
10.6.2025 | 14:23
Ůa er ekkert grÝn a stÝga ß tŠr lyfjaframleienda
Nřlegar ßkvaranir Roberts F Kennedy Jr. heilbrigisrßherra valda titringi meal stjˇrnenda lyfjaframleienda vestra enda vega ■Šr a fjßrhagslegri afkomu framleienda ■ar sem ■Šr raska rˇtgrˇnu sjßlfsafgreislukerfi ■eirra hjß heilbrigiskerfinu:
- RFK rifti $700 milljˇna samningi rßuneytisins vi Moderna sem Štla var a flřta fyrir ferli nřs mRNA fuglaflensubˇluefnis ß marka. ┴stŠan sem rßuneyti gaf fyrir samningsslitum eru Ý klippu og hljˇma kunnuglega ■eim sem hafa efasemdir um ÷ryggi Covid mRNA bˇluefnanna.
- RFK snÚri vi einhverri umdeildustu ßkv÷run sˇttvarnaeftirlitsins CDC a gera Covid bˇluefnin a hluta barnabˇlusetningar ߊtlunarinnar.
- ═ gŠr tilkynnti forstjˇri lyfjaeftirlitsins FDA um rannsˇkn ß Covid bˇluefna skaanum. Niurst÷ur rannsˇknar lyfjaeftirlitsins munu a lÝkindum koma til me a hafa mikil ßhrif um heim allan og m.a. auvelda sk÷uum og fj÷lskyldum lßtinna a leita rÚttar sÝns.
- RFK sagi ÷llu rßgjafarßi (ACIP) sˇttvarnarstofnunarinnar CDC upp st÷rfum Ý gŠr. Taldi rßherrann ˇviunandi hvernig einstakir melimir rßsins tengdust lyfjaframleiendum og fŠru me augljˇsum hŠtti Ý einu og ÷llu a ■eirra vilja Ý st÷rfum sÝnum.
- Ef til vill er stŠrsta ßkv÷runin tengd Covid bˇluefnunum brÚf FDA (brÚfi mß lesa ß heimasÝu lyfjaeftirlitsins) til Pfizer og Moderna ■ar sem ■eim er gert a uppfŠra fylgiseil Covid bˇluefnanna me upplřsingum um hŠttuna ß hjartabˇlgu Ý kj÷lfar bˇlusetninga. ═ brÚfinu til lyfjaframleiendanna er vÝsa til fj÷lda langtÝma rannsˇkna, ■ar ß meal einnar sem sřnir a af 331 fengu 278 hjartatengdar aukaverkanir Ý kj÷lfar Covid bˇlusetninga.
HlutabrÚf Pfizer hafa lŠkka um 9% og Moderna um 32% frß ßramˇtum.
10.6.2025 | 07:53
Eftirlitsailar bregast trausti
DßnarlÝkur Moderna tvÝbˇlusettra 2021 ß aldrinum 46 til 69 ßra reyndust 50% hŠrri en ■eirra sem fengu Pfizer. ŮvÝ vekur furu ■egar eftirlitsailar veita nřju mRNA Covid bˇluefni Moderna, mNEXSPIKE, markasleyfi ß grundvelli klÝnÝskrar rannsˇknar ■ar sem nřja efni var bori saman vi eldra efni sem hafi reynst svo hŠttulegt a notkun ■ess var hŠtt vÝa. Meal annars ß ═slandi ■ar sem hŠtt var a nota efni Ý febr˙ar 2022 ■egar landsmenn h÷fu ■egi 98.450 sprautur af Moderna. ═slenskir eldri borgarar vera a vona a nři landlŠknirinn geri rÝkari kr÷fur en eftirlitsailinn til ÷ryggis bˇluefnisins og af■akki kaup ß efninu.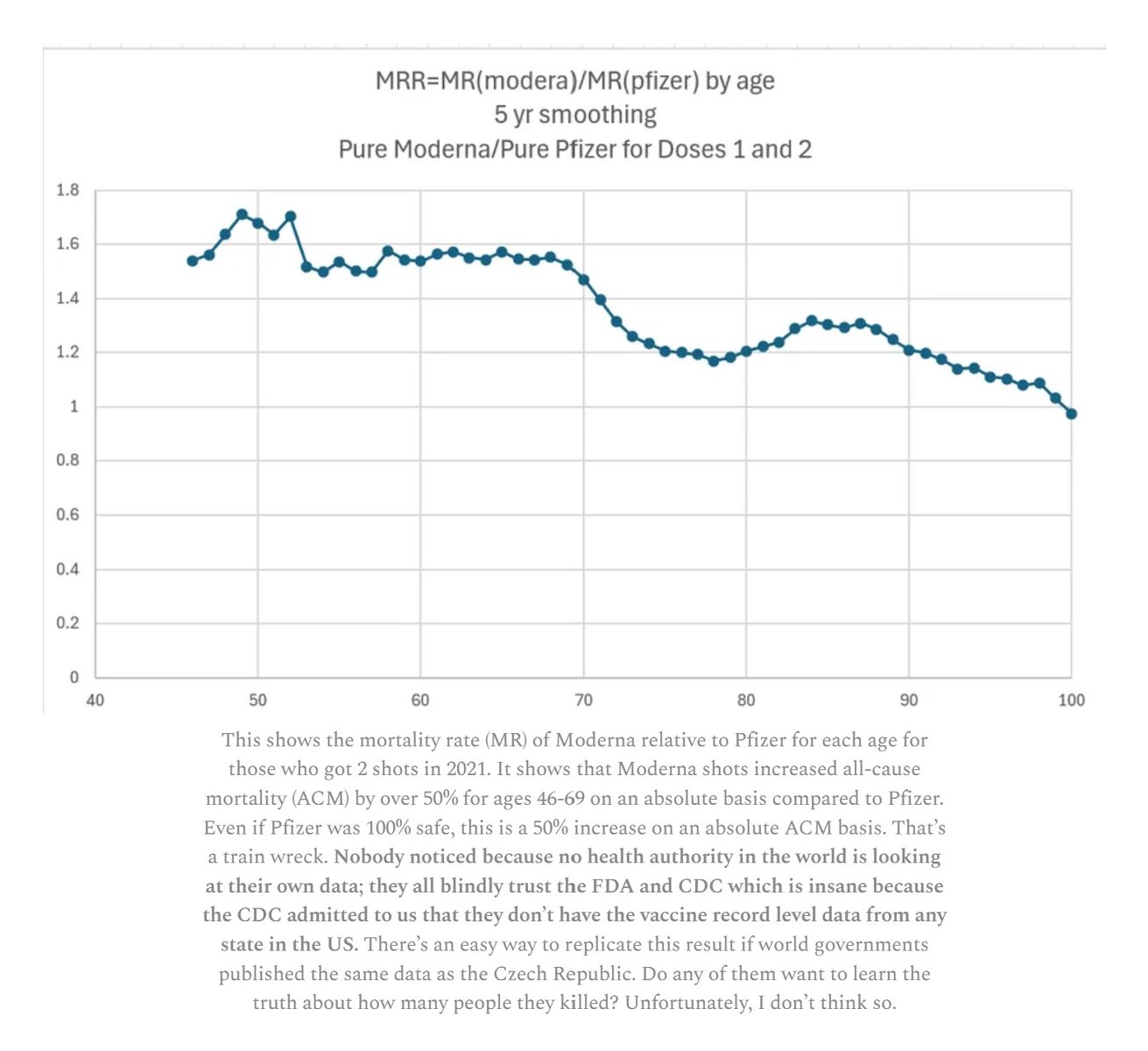
9.6.2025 | 09:49
Hlutfall landsmanna ß endurhŠfingarlÝfeyri tv÷faldast
A mealtali fengu 2,8% landsmanna ß aldrinum 18-66 ßra greiddan endurhŠfingarlÝfeyri ß ßrinu 2024 samkvŠmt ßrsskřrslu Tryggingastofnunar. Hlutfalli var 1,3% ß ßrunum 2020 til og me 2022. T÷lur TR ßsamt ■eirri stareynd a ˇvÝa meal ■jˇa heims hafa hlutfallslega fleiri ■egi Covid mRNA bˇluefni en hÚr ß landi ß sama tÝma og ═sland skipast ßr eftir ßr Ý hˇp ■eirra ■jˇa Evrˇpu sem hŠst hafa hlutfall umframdausfalla eru enn ein vÝsbendingin um skasemi bˇluefnanna. HlistŠri reynslu greina Japanskir vÝsindamenn frß Ý grein Ý fagtÝmaritinu JMA Journal.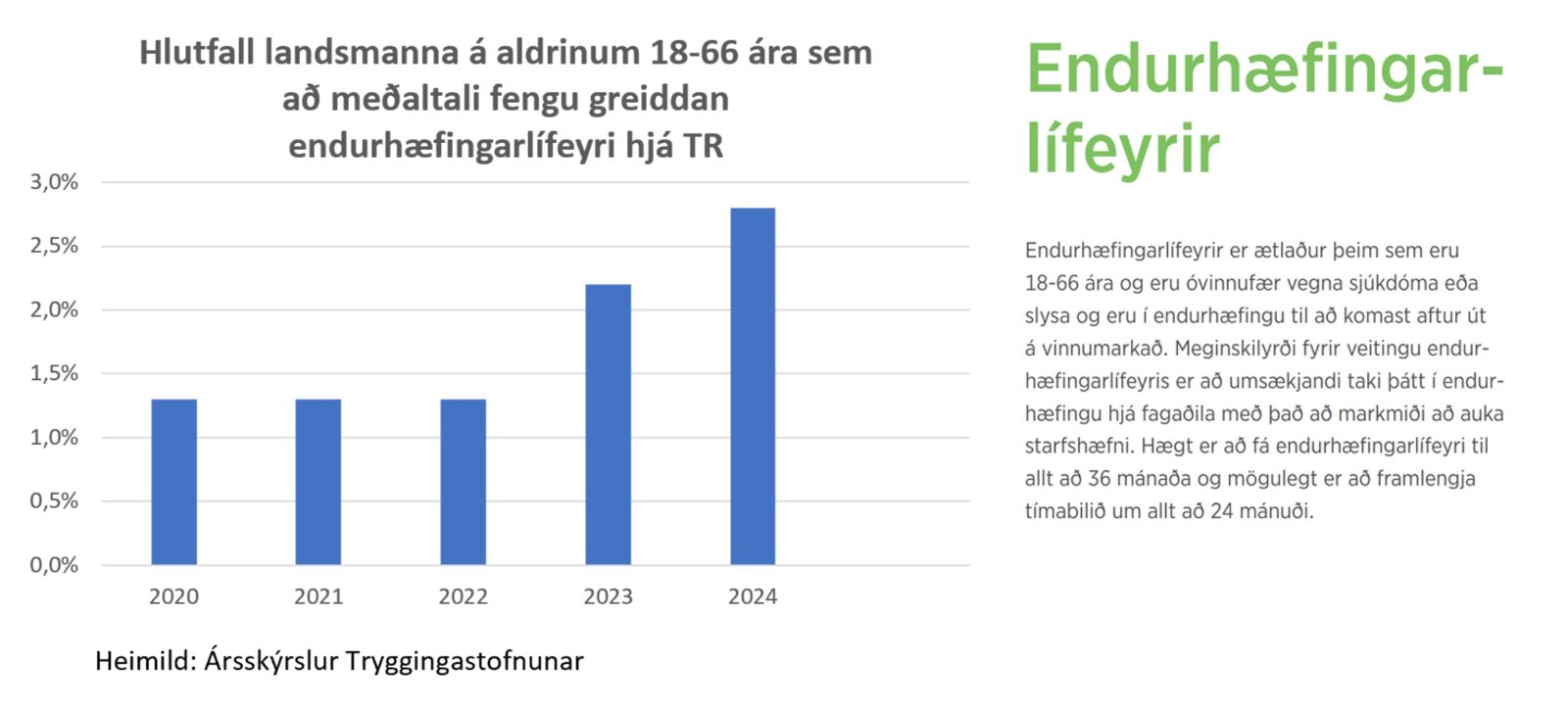
8.6.2025 | 17:32
Alvarlegar aukaverkanir 5,3% ungbarna Ý klÝnÝskri rannsˇkn MenQuadfi vi meningˇkokkum
FŠstir heilbrigisstarfsmenn og foreldrar gera sÚr grein fyrir a lÝklega hefur ekkert bˇluefnanna sem notu eru Ý almennum barnabˇlusetningum ß ═slandi undirgengist tvÝblinda klÝnÝska rannsˇkn ■ar sem samanburarhˇpnum var gefin lyfleysa (ˇvirkt efni ea saltlausn). Hvernig FDA stˇ a sam■ykkt markasleyfis fyrir bˇluefni MenQuadfi sem gefi er vi meningˇkokkum vi eins ßrs aldur ß ═slandi lřsir Ý hvert ˇefni er komi Ý starfshßttum FDA.
Leyfi FDA ß ManQuadfi bˇluefninu byggir ß klÝnÝskri rannsˇkn ■ar sem bˇluefni var bori saman vi bˇluefni Menveo. ═ rannsˇkninni fengu 5,3% ungbarnanna sem voru sprautu me MenQuadfi alvarlegar aukaverkanir og 3,6% barnanna sem sprautu voru me Menveo. Skilgreining FDA ß alvarlegri aukaverkun er t.d. daui, spÝtalainnl÷gn og fŠingargalli. Ůrßtt fyrir a hlutfall ungbarna sem fengu alvarlegar aukaverkanir af MenQuadfi vŠri hßtt og umtalsvert hŠrra en ■eirra sem sprautu voru me Menveo ßkva FDA engu a sÝur a ˙rskura bˇluefni MenQuadfi „÷ruggt“ til notkunar Ý smßb÷rnum vegna eldri ßkv÷runar FDA um leyfi Menveo til handa. Leyfi Menveo byggi ß samanburi vi virkni bˇluefnisins Menactra. Menactra hafi fengi leyfi sem byggi ß klÝnÝskri rannsˇkn me samanburi vi bˇluefni Menomune frß 1978 en ■a bˇluefni hafi ekki veri reynt Ý klÝnÝskri rannsˇkn eftir ■vÝ sem hŠgt er a finna Ý heimildum en kr÷fur um skj÷lun rannsˇkna var ekki jafn stÝf ■ß og n˙ til dags.
Notkun MenQuadfi treystir ß samanbur keju klÝnÝskra rannsˇkna ■ar sem virk efni en ekki lyfleysa var gefin samanburarhˇpnum a sÝasta bˇluefninu undanskyldu sem ekki var reynt Ý klÝnÝskri rannsˇkn og leyfi bˇluefnanna sem ß eftir komu grundvallast ß.
Tveggja ßra rannsˇkn blaamanna ß heilbrigissvii Ý The Lever leiir Ý ljˇs a FDA (lyfjaeftirlit USA) hefur gefi markasleyfi fyrir hundruum lyfja ßn sannana um virkni og jafnvel vitandi um skalegar afleiingar efnanna. Me ■vÝ a kanna hvernig stai var a  leyfisveitingu yfir 400 lyfja ß ßrunum 2013 til og me 2022 kom Ý ljˇs a margsinnis fˇr lyfjaeftirliti gegn eigin st÷lum um vÝsindaleg vinnubr÷g vi mat ß leyfisumsˇknum. Vinnubr÷g FDA skipta ═slendinga mßli ■ar sem EMA (evrˇpska lyfjaeftirliti) tekur flestu ■vÝ sem frß FDA kemur ßn gagnrřni og ■ar me eru lyfin komin me leyfi ß ═slandi.
leyfisveitingu yfir 400 lyfja ß ßrunum 2013 til og me 2022 kom Ý ljˇs a margsinnis fˇr lyfjaeftirliti gegn eigin st÷lum um vÝsindaleg vinnubr÷g vi mat ß leyfisumsˇknum. Vinnubr÷g FDA skipta ═slendinga mßli ■ar sem EMA (evrˇpska lyfjaeftirliti) tekur flestu ■vÝ sem frß FDA kemur ßn gagnrřni og ■ar me eru lyfin komin me leyfi ß ═slandi.
Niurst÷ur athugunar rannsˇknarblaamannanna eru slßandi. 73% lyfjanna sem fengu markasleyfi uppfylltu ekki allar fjˇrar forsendur leyfisveitingar sem l˙ta a framkvŠmd og fyrirkomulagi klÝnÝskra rannsˇkna, gagnsemi lyfjanna auk virkni ß sj˙klinga. Einungis lilega fjˇrungur lyfjanna uppfylltu ÷ll fj÷gur skilyrin og 40 lyf uppfylltu ekkert fj÷gurra skilyra FDA. Fremur en a horfa til ÷ryggis lyfjanna hraar lyfjaeftirliti afgreislu markasleyfa Ý vaxandi mŠli undir ■rřstingi lyfjaframleienda sem n˙ fß markasleyfi fyrir lyfjum ßur en vita er hvort ■au virki og sÚu ÷rugg me lofori um a kanna lyfi eftirß Ý klÝnÝskum rannsˇknum. Ůessir breyttu starfshŠttir FDA hafa ■rˇast ßn ■ess a lŠknar og almenningur hafi ßtta sig ß breytingunni.
A s÷gn h÷funda eru ■essi h÷rmulegu vinnubr÷g hvergi eins ßberandi og ß svii krabbameinslŠkninga. Aeins 3 af 123 krabbameinslyfjum uppfylltu ÷ll fj÷gur skilyri FDA fyrir veitingu leyfis. ═áfŠrslu Maryanne Demasi PhD eru tv÷ krabbameinslyf nefnd sÚrstaklega. Jafnframt er ■ar hlekkur ß grein blaamannanna Ý The Lever sem ekki er a baki greisluveggs en krafist er netfangs til a opna hana.
Myndin er ˙r skřrslu um starfsemi gagnagrunns Vestur-┴stralÝu (V┴) sem tekur vi tilkynningum um aukaverkanir Ý kj÷lfar bˇlusetninga. V┴ lokai landamŠrum fylkisins Ý aprÝl 2020. ═b˙arnir voru einkennalausir af SARS-CoV-2 veirunni sem veldur Covid veikinni Ý febr˙ar 2021 ■egar bˇlusetningar gegn Covid hˇfust. S˙luriti sřnir hvernig tilkynningar um aukaverkanir Ý kj÷lfar bˇlusetninganna tˇku a hlaast inn Ý gagnagrunninn. Ůar sem Ýb˙ar fylkisins voru einkennalausir af Covid ■egar bˇlusetningarnar hˇfust verur sj˙kdˇmnum ekki kennt um ßlagi ß spÝtala fylkisins Ý kj÷lfari. Tilkynningar um skaa af v÷ldum mRNA efnanna voru 24 sinnum fleiri en vegna allra annarra bˇluefna samanlagt.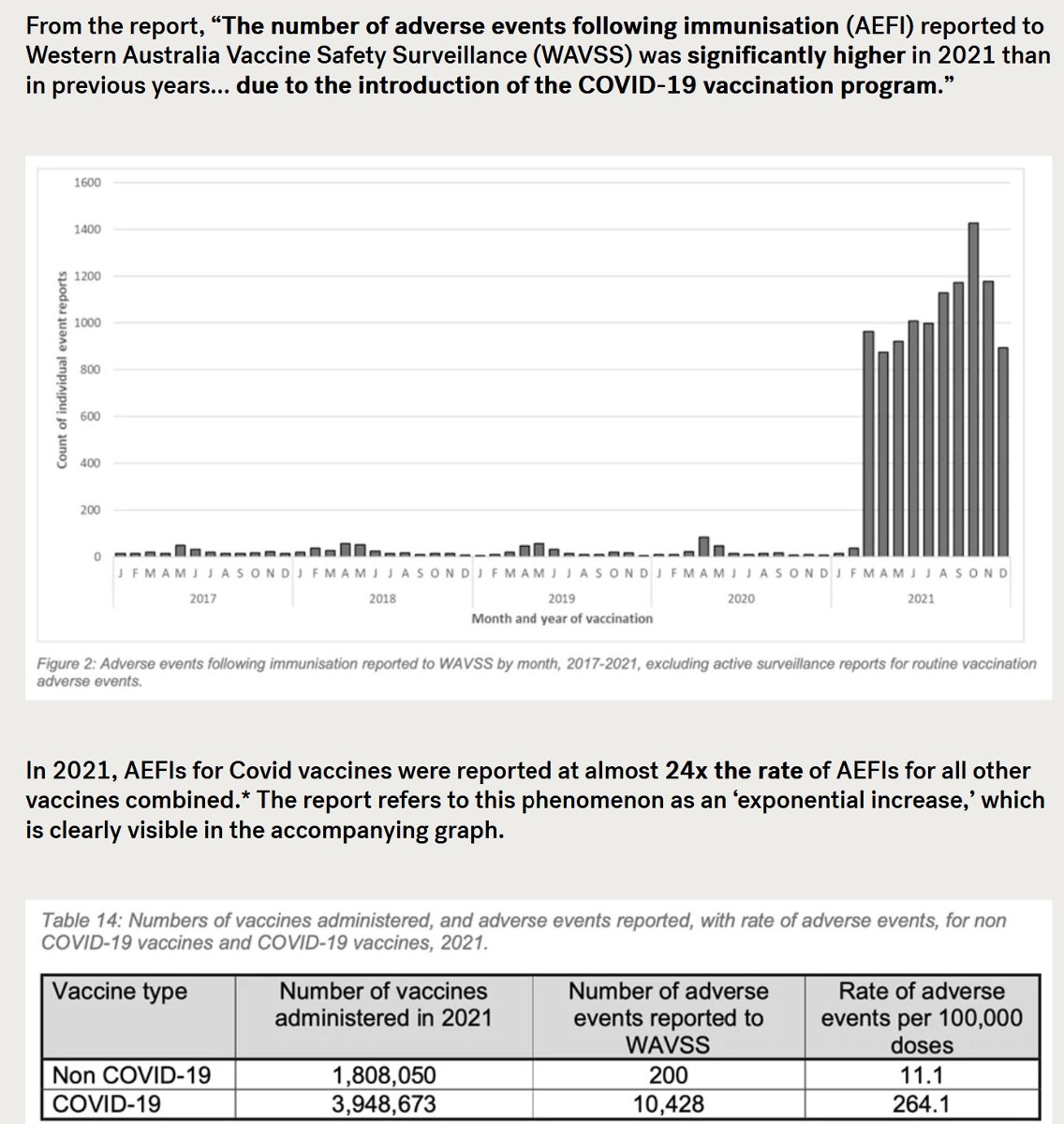
Grein ■jˇ■ekktra Japanskra vÝsindamanna Ý fagtÝmariti JMA Journal endurspeglar reynslu ═slendinga en ˇvÝa meal ■jˇa heims hafa hlutfallslega fleiri ■egi Covid mRNA bˇluefni en hÚr ß landi ß sama tÝma og  ═sland skipast ßr eftir ßr Ý hˇp ■eirra ■jˇa Evrˇpu sem hŠst hafa hlutfall umframdausfalla.áVÝsindamennirnir telja brřna ßstŠu til a kanna hvort samband sÚ ß milli verulegrar fj÷lgunar umframdausfalla Ý Japan Ý kj÷lfar ÷rvunarbˇlusetninga en Japanir eiga heimsmet Ý fj÷lda Covid mRNA sprautuskammta me 3,6 ß mann. (r˙mlega 2 ß ═slandi). Telja ■eir mRNA bˇlusetningarnar hafa stula a umframdausf÷llunum. Hugsanlega af ßstŠum eins og ˇnŠmisbŠlingu, hjarta- og Šasj˙kdˇmum, krabbameini ea langvinnum sřkingum. Kalla vÝsindamennirnir eftir tafarlausum rannsˇknum ß langtÝma÷ryggi og virkni mRNA bˇluefnanna.
═sland skipast ßr eftir ßr Ý hˇp ■eirra ■jˇa Evrˇpu sem hŠst hafa hlutfall umframdausfalla.áVÝsindamennirnir telja brřna ßstŠu til a kanna hvort samband sÚ ß milli verulegrar fj÷lgunar umframdausfalla Ý Japan Ý kj÷lfar ÷rvunarbˇlusetninga en Japanir eiga heimsmet Ý fj÷lda Covid mRNA sprautuskammta me 3,6 ß mann. (r˙mlega 2 ß ═slandi). Telja ■eir mRNA bˇlusetningarnar hafa stula a umframdausf÷llunum. Hugsanlega af ßstŠum eins og ˇnŠmisbŠlingu, hjarta- og Šasj˙kdˇmum, krabbameini ea langvinnum sřkingum. Kalla vÝsindamennirnir eftir tafarlausum rannsˇknum ß langtÝma÷ryggi og virkni mRNA bˇluefnanna.
Grok svarai fyrirspurn um h÷funda greinarinnar me eftirfarandi hŠtti:
5.6.2025 | 09:19
VAERS me 34 Ýslensk dausf÷ll 2021 og 2022
VAERS (Vaccine Adverse Event Reporting System) gagnagrunnurinn Ý USA, Ý umsjˇn CDC sˇttvarnastofnunarinnar og FDA lyfjastofnunarinnar, tekur vi tilkynningum um aukaverkanir Ý kj÷lfar bˇlusetninga. ═ VAERS eru 1.177 tilkynningar um skaa af v÷ldum covid bˇluefna ß ═slandi. Meal tilkynninga eru 19 um varanlega ÷rorku Ý kj÷lfar bˇlusetninga, 16 um fŠingargalla og 34 tilkynningar um dausf÷ll. Ůar af eru 31 dausfall 2021 og 3 dausf÷ll 2022.
Athygli vekja tilkynningar um 34 Ýslensk dausf÷ll af v÷ldum Covid bˇluefna sem ekki eru skrß sem slÝk Ý dßnarmeinaskrß landlŠknis fyrir ßrin 2021 og 2022.
Ůar sem tilkynningar Ý VAERS eru valfrjßlsar ÷rum en heilbrigisstarfsm÷nnum og starfsm÷nnum lyfjaframleienda vegna tiltekinna tegunda aukaverkana er varfŠrnislega tali a margfalda megi fj÷lda vŠgra aukaverkana me 10 og alvarlegar aukaverkanir me 2 til 5 til til a nßlgast raunverulegan fj÷lda aukaverkana af v÷ldum bˇluefna. Tilkynningar um alvarlegar aukaverkanir eins og dausf÷ll eru studdar dßnarvottorum.
T÷lurnar um Ýslenska bˇluefnaskaann eru ß sÝunniáwww.VaersAware.com sem hefur sÚrhŠft sig Ý vinnslu upplřsinga ˙r VAERS. A kr÷fu Evrˇpskra eftirlitsailans hafa tilteknar upplřsingar Ý VAERS eins og upprunaland tilkynninga veri gerar almenningi ˇagengilegar. Ůa kann a skřra hvers vegna ekki eru finnanlegar upplřsingar um Ýslenskar aukaverkanir bˇluefna Ý VAERS eftir 2022.
EMA (Evrˇpska lyfjastofnunin) rekur EudraVigilance sem geymir tilkynningar um bˇluefnaskaa ß Evrˇpska efnahagssvŠinu. ═ grunninum eru lilega 6.400 skaatilkynningar vegna Covid bˇluefna ß ═slandi. Ůar af vegna bˇluefna Pfizer 2.910, Jansen 1.460, AstraZenica 1.200 og Moderna 870.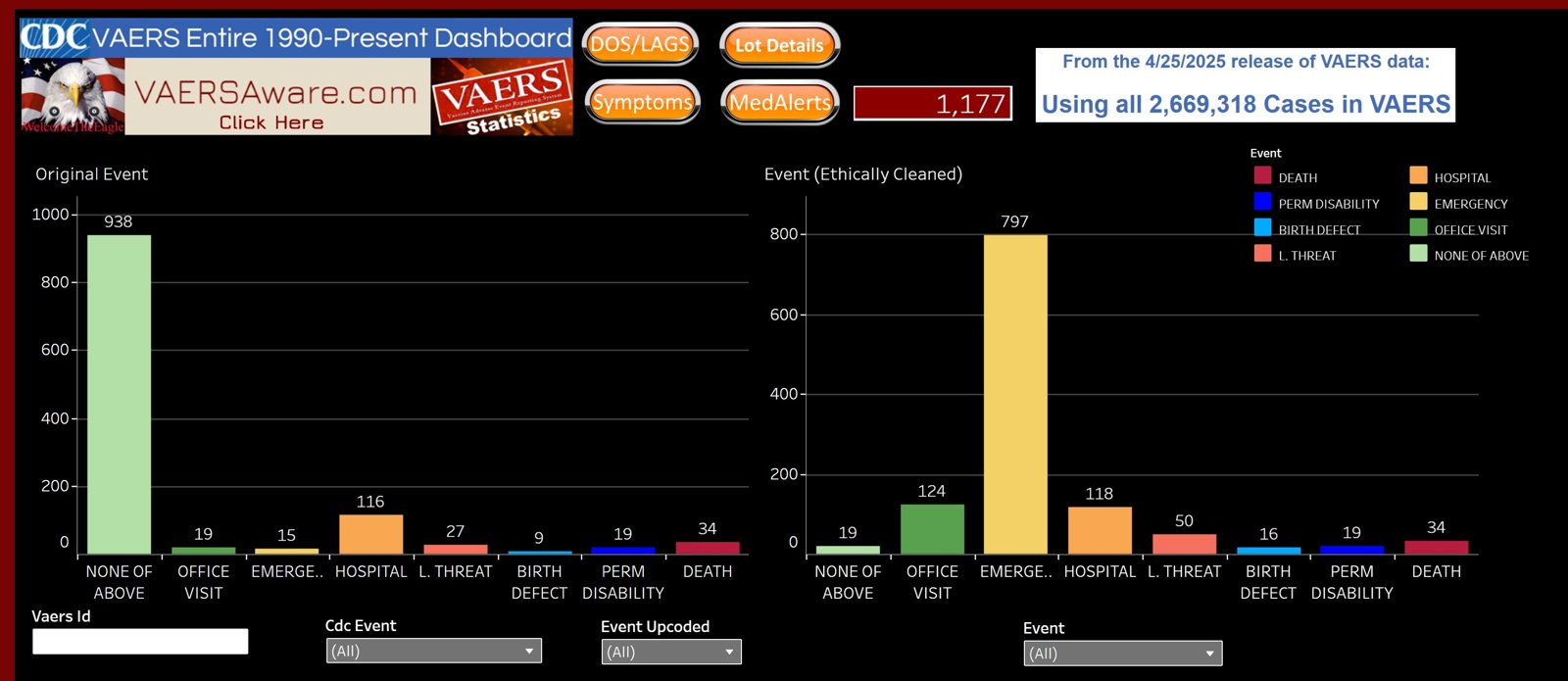
4.6.2025 | 10:43
LandlŠknir kveikti ekki ß perunni
Efri myndin sřnir tilkynningar inn Ý gagnagrunn Vestur-┴stralÝu um bˇluefnaskaa og birtist me ßskorun Ý blaagrein til landlŠknis Ý maÝ 2023 um st÷vun bˇlusetninga. Svo augljˇslega stafestir myndin bˇluefnaskaann a jafnvel var hŠgt a Štlast til a n˙verandi heilbrigisrßherra og ■ßverandi landlŠknir myndi kveikja ß perunni og hŠtti a halda ÷rvunarbˇluefninu a eldri borgurum. ŮvÝ miur bar henni ekki gŠfa til ■ess. Neri myndin er ˙r gagnagrunni Mortality Watch og sřnir dapra st÷u ═slands Ý Evrˇpu ßr eftir ßr ■egar l÷ndunum er raa samkvŠmt aldursleirÚttri umframdßnartÝni. Gagnabanki WHO upplřsir a ═sland er fjˇra ÷rvunarbˇlusettasta ■jˇ heimsins og Ý efsta sŠti Evrˇpu■jˇa.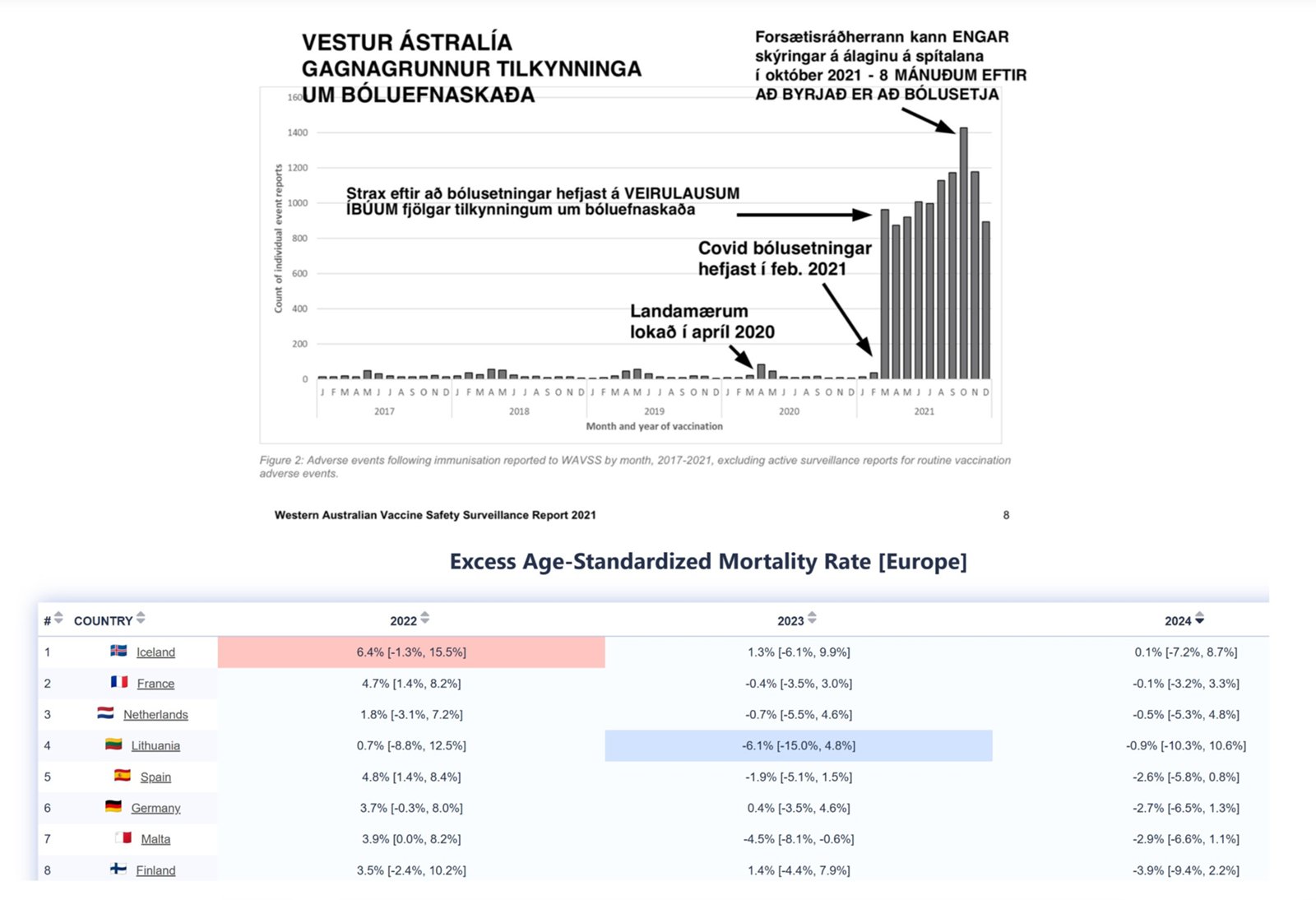
3.6.2025 | 14:06
Til ■ess eru mist÷kin a lŠra af ■eim
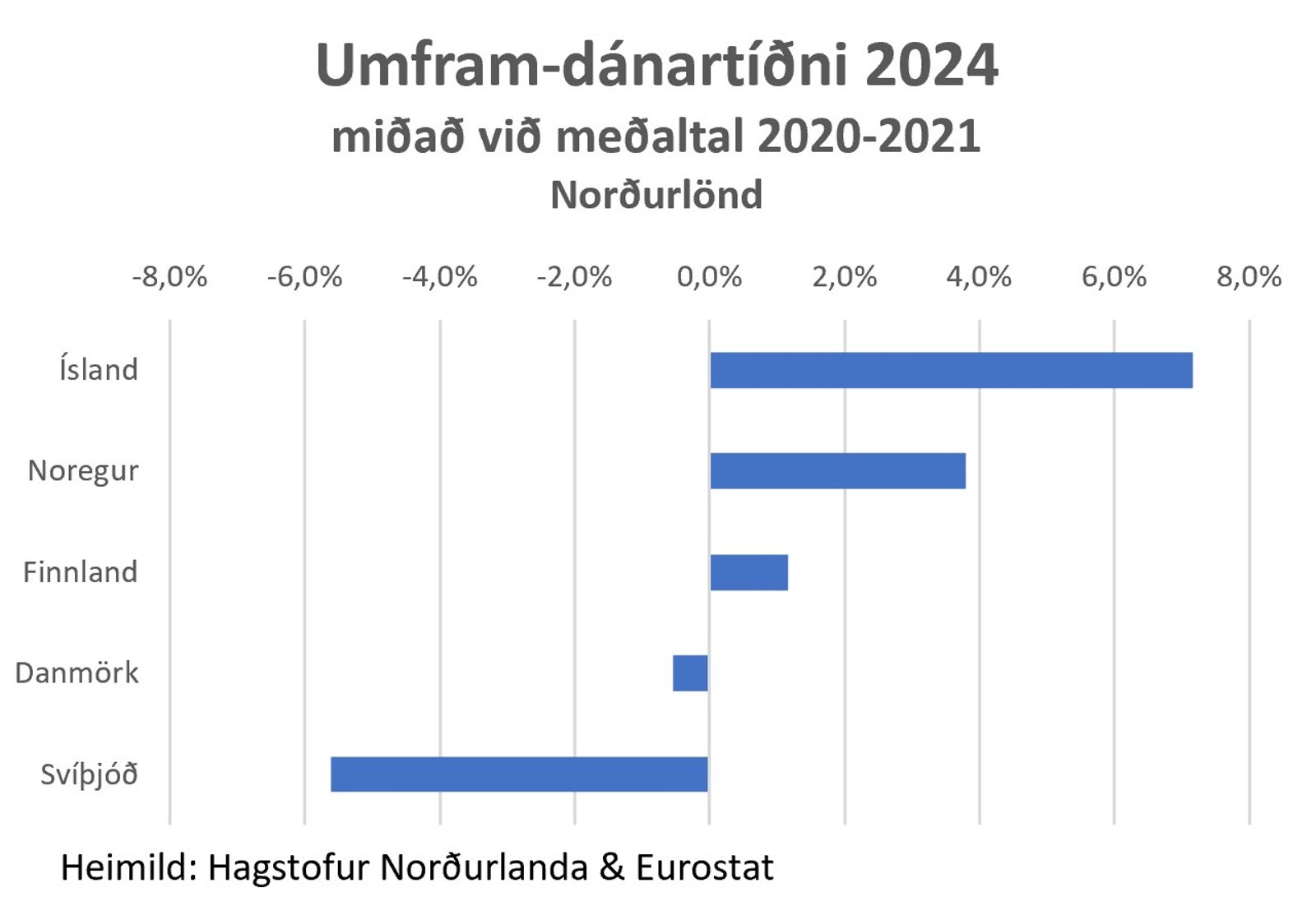
A betur hafi mßtt standa a sˇttv÷rnum hÚr ß landi verur ljˇsara me hverju ßrinu sem lÝur frß covid. Dßnart÷lur ßrsins 2024 sřna sÚrst÷u ═slands meal Norurlandanna ■ar sem borinn er saman fj÷ldi lßtinna ß ßrinu 2024 vi ßrin 2020 og 2021 a teknu tilliti til fj÷lgunar landsmanna. Af minna tilefni hefur veri skipaur starfshˇpur sÚrfrˇra. Honum yri m.a. fali a kanna hvernig ß ■vÝ stendur a ═sland raast ßrlega meal ■eirra ■jˇa Evrˇpu sem hŠst hafa hlutfall umframdausfalla og hvers vegna landsm÷nnum er gert a b˙a vi vivarandi hŠkkaa dßnartÝni ß ═slandi eftir faraldur ß sama tÝma og dßnartÝnin hefur fari lŠkkandi hjß flestum Evrˇpul÷ndum og leita Ý svipa horf og var fyrir 2020.